Hay una fotografía de LaDonna Lopossa que ayuda a contar la historia. Ella es todo sonrisas, acostada en la hierba de una manera vagamente Betty Grable sobre su propia parcela en el cementerio. El retrato fue idea de su esposo, en sus décadas juntos parece que George, alias Mr. No Serious, nunca vio una mordaza que no le gustó, pero fue LaDonna quien se le ocurrió la pose de tarta de queso.
contenido relacionado
- Grandes esperanzas para un nuevo tipo de gen
- Los 'judíos secretos' del valle de San Luis
"Está bien", había dicho George, "ahora quítate la camisa".
"¡Jorge!"
Hacer clic.
Por un lado, es una instantánea tonta de una mujer de 60 años en un cárdigan y sandalias sensatas en Winlock, Washington, un día soleado en mayo de 2000. Por otro lado, es un vistazo de un posible futuro en el que la ciencia ha resuelto Un problema temible. Porque así es como LaDonna y George se enfrentaron a su cáncer letal, no solo silbando más allá del cementerio sino haciendo payasadas en medio de él.
Tres meses antes, LaDonna estaba acostada en una cama de hospital en Olympia a punto de bajar el telón. Había mucho que dejar: cuatro hijos adultos, varios nietos, amigos en la iglesia, un buen matrimonio. (No importa que, mientras yacía allí, George les decía en voz alta a las enfermeras que iba a ir a los barrotes para encontrar otra esposa, lo que ella entendió como su extraño esfuerzo para tranquilizarla.) Estaba lista para dejar a todos y todas esas cosas y más por el dolor.
Su bazo, normalmente metido debajo de la costilla izquierda más baja y no más grande que un durazno, estaba tan lleno de glóbulos blancos que tenía el tamaño de un melón. Apenas podía caminar. Su piel era fantasmal, su sangre peligrosamente corta de glóbulos rojos. Respirar era una tarea. Vómitos regulares. Dolores punzantes en lo profundo de sus huesos, donde la médula estaba produciendo frenéticamente glóbulos blancos o leucocitos. Fiebres recurrentes. Y frío, extrañamente, inquietantemente frío : se estaba congelando bajo las mantas del hospital.
Era demasiado vieja y estaba demasiado enferma para someterse a un trasplante de médula ósea, un tratamiento agotador y altamente riesgoso para su cáncer de sangre, leucemia mieloide crónica (LMC). Ella ya había probado el otro tratamiento estándar de CML, dosis regulares del poderoso compuesto de interferón. Pero intensificó tanto sus náuseas, fiebres y dolor de huesos que abandonó la medicación, pase lo que pase. Sin nada en su arsenal de lucha contra la leucemia, los doctores se redujeron a Dilaudid, un derivado de la morfina, el analgésico narcótico. Fue tranquilizador, reconfortante y para una paciente en su condición, por supuesto, era el final.
George había regalado la mayoría de sus pertenencias y había reservado un camión de U-Haul para llevar sus cosas al sur de California, donde se mudaría con uno de sus hijos. La música para su funeral fue elegida, incluyendo "Porque me han dado mucho", para que la cantaran los nietos. Cuando el hospital recomendó trasladar a LaDonna a un hospicio, George la llevó a su casa y siguió el consejo de su médico para convocar a los niños; Terry, Darren y Stephen volaron desde el área de Los Ángeles, y Kelly condujo desde su casa en Winlock. Uno por uno fueron a la habitación, se sentaron al lado de la cama de LaDonna y se despidieron.
La CML es uno de los cuatro tipos principales de leucemia en adultos, pero no es común, afecta a 5.000 personas en los Estados Unidos cada año. Como regla, es fatal, y la mayoría de los pacientes mueren dentro de los cinco años posteriores al diagnóstico. La primera fase, una explosión sigilosa de glóbulos blancos normales, puede durar meses o años; Los pacientes a menudo son alertados de la condición mediante un análisis de sangre de rutina. Si la enfermedad no se controla, los glóbulos blancos se vuelven cada vez más anormales, emitiendo helter-skelter de células madre particulares en la médula ósea llamadas células mieloides; tales leucocitos revientan capilares, abruman órganos y sofocan tejidos al desplazar a los glóbulos rojos que transportan oxígeno. El curso de la enfermedad es excepcionalmente predecible, dicen los médicos, pero su naturaleza mecánica también ha brindado a los científicos una oportunidad: al inmiscuirse en los engranajes moleculares y resortes que impulsan la CML, la entienden mejor que cualquier otro cáncer.
Una vez, a principios de diciembre de 1999, George conducía para ver a LaDonna en el hospital de Olympia y se detuvo en Safeway para comprar un periódico. El Sr. No Serio es un ávido lector, incluso había dirigido brevemente una librería con LaDonna, y devoró el periódico en la habitación de su hospital. Como sucedió, un tratamiento experimental de leucemia estaba en los titulares. "La píldora contra la leucemia es prometedora", informó Associated Press, diciendo que los pacientes con CML "tenían recuentos sanguíneos normales dentro de un mes de comenzar el tratamiento". El estudio se estaba llevando a cabo en la Oregon Health & Science University (OHSU) en Portland.
George salió a toda prisa de la habitación del hospital para buscar al oncólogo de LaDonna.
Objetivo para la intervención
Un camino empinado, sinuoso y arbolado conduce al campus principal, que se alza cerca de la cumbre de Marquam Hill de 574 pies de altura y en días de niebla parece flotar sobre la ciudad como un castillo en un cuento de hadas. Otra ruta hasta OHSU es el teleférico de Portland: dos autos de góndola de acero reluciente de fabricación suiza se elevan sobre cables a lo largo de la Interestatal 5, zumbando personas de un lado a otro entre la orilla oeste del río Willamette y una plataforma de hospital encaramada más cerca del borde de un acantilado de lo que los pacientes cardíacos que desembarcan podrían desear que sea.
Brian Druker llegó a OHSU en 1993, años antes de que se construyera el tranvía y el mural del salón de la fama en el pasillo adyacente incluyera una foto de él. Alto, tan larguirucho y liviano como un galgo, de voz suave, Druker tenía 38 años y acababa de pasar nueve años en el Instituto del Cáncer Dana-Farber, parte de la Escuela de Medicina de Harvard, en Boston. "Vi el cáncer como un problema manejable", recordó sobre el camino de investigación que eligió después de terminar la escuela de medicina en la Universidad de California en San Diego. "La gente comenzaba a tener algunas pistas y algunas pistas y me pareció que en mi vida probablemente cedería ante la ciencia y el descubrimiento".
En Dana-Farber, Druker aterrizó en un laboratorio estudiando cómo una célula humana normal da lugar a un crecimiento desbocado: malignidad. Entre otras cosas, el laboratorio se centró en las enzimas, proteínas que cambian otras moléculas al descomponerlas (las enzimas intestinales, por ejemplo, ayudan a digerir los alimentos) o unirlas (las enzimas del folículo piloso construyen fibras de queratina sedosas). Las enzimas también figuran en reacciones en cadena, con una enzima activando a otra y así sucesivamente, hasta que se logra una hazaña celular compleja; por lo tanto, una célula puede controlar un proceso como el crecimiento o la división iniciando una reacción única, como dar la vuelta al primer dominó. Bajo el jefe del laboratorio, Thomas Roberts, Druker dominó numerosas técnicas para rastrear y medir enzimas en muestras de tejido, y finalmente recurrió a una implicada en la LMC.
Determinar los detalles de por qué esta enzima en particular es la clave para la CML había involucrado a cientos de científicos de todo el mundo, investigaciones que conducirían a varios Premios Nobel, pero aquí es básicamente donde comenzó Druker:
Primero, todos los pacientes con LMC tienen la enzima renegada en sus glóbulos blancos.
En segundo lugar, la enzima en sí misma es el producto de un gen anormal, llamado BCR-ABL, formado durante la división de una célula madre mieloide y luego transmitido a miles de millones de descendientes: las puntas de dos cromosomas, esas estructuras espinosas que almacenan ADN, en realidad intercambian lugares, lo que hace que los genes separados llamados BCR y ABL se fusionen (ver ilustración). El nuevo gen mutante BCR-ABL se encuentra en un cromosoma peculiar descubierto en 1960 por científicos de la Universidad de Pensilvania. Este "cromosoma Filadelfia", visible a través de un microscopio, es el sello distintivo de CML.
Tercero, la enzima BCR-ABL es el gemelo malvado de una enzima normal que ayuda a controlar la producción de glóbulos blancos. Pero como un interruptor atascado en la posición "encendido", el mutante estimula la proliferación salvaje que es la leucemia.
No era necesario ser médico de Harvard para ver que una sola enzima que causa una leucemia mortal era, como dicen los investigadores, un objetivo atractivo para la intervención. Y, de hecho, los científicos se propusieron encontrar o inventar compuestos que pudieran bloquear la enzima BCR-ABL.
Druker y sus colaboradores de Boston, utilizando anticuerpos especialmente diseñados, desarrollaron una nueva forma de medir la actividad de la enzima, una herramienta que resultaría invaluable para evaluar posibles tratamientos para la LMC. Druker, médico que llevaba corbata entre los doctores vestidos de mezclilla, compitió con competidores en otros centros de investigación para encontrar un medicamento que suprima el cáncer al deshabilitar una enzima crítica y ahorrar tejidos sanos en el negocio. Por tradición, los tratamientos contra el cáncer bombardearon el cuerpo con medicamentos potentes, matando a las células sanas y cancerosas por igual: "quimioterapia citotóxica", lo llaman los médicos. La alternativa, la terapia dirigida, combatiría mejor el cáncer con menos daño colateral, o al menos esa era la noción que a menudo mantenía a Druker en el laboratorio hasta las 11 de la noche.
Entonces las cosas comenzaron a desmoronarse. “Mi matrimonio se había roto. No era lo que llamarías un esposo devoto. Fui un dedicado investigador, científico y médico. Y eso tuvo un costo ”. (Druker y su esposa se separaron después de dos años de matrimonio y luego se divorciaron).
Aún así, con una puntuación de estudios publicados y una ingeniosa técnica de medición de enzimas para demostrar sus esfuerzos, Druker pensó que estaba listo para ascender en la escala de Harvard de instructor a profesor asistente. "Me senté con el jefe de oncología médica en Dana-Farber", recordó Druker. "Revisó mi currículum y dijo: 'Simplemente no creo que este trabajo vaya a ir a ningún lado aquí'". Traducción: "Me dijeron que no tenía futuro en Dana-Farber".
"Fue horrible", recordó. "Estaba deprimido. Pero me obligó a decir realmente: ¿Creo en mí mismo? ¿Voy a lograrlo, marcar la diferencia?
Preocupacion creciente
Cuando se le pidió que describiera el enfoque de Druker, un científico dijo que se reducía a "perseverancia y terquedad al no dejar ir una idea".
"Creo intrínsecamente que es una persona tímida", dijo otro. "Pero en esto", la terapia contra el cáncer, "es como un cruzado".
"Toma todo lo que es complicado, lo mete en su mente y genera la interpretación e intervención más simple posible".
“Cuando haces una pregunta, hay silencio en la habitación, un silencio casi incómodo, y tú estás como, ¿me escuchó? Piensa bien las cosas antes de dar una respuesta.
"Deja que la ciencia hable".
Druker creció siendo el más joven de cuatro niños en St. Paul, Minnesota, y asistió a escuelas públicas, sobresaliendo en matemáticas y ciencias. Su padre era químico en 3M, cuyo trabajo en procesos de impresión fue patentado. Su madre era una ama de casa que se involucró en la política de la junta escolar y se postuló sin éxito a la legislatura estatal. Después de graduarse con un título en química de la Universidad de California en San Diego, se quedó y, en 1978, su primer año en la escuela de medicina, escribió un artículo de 16 páginas que insinuaba un futuro que ayudaría a crear. Escrito a mano con tinta azul en papel de cuaderno rayado y titulado “Quimioterapia contra el cáncer”, concluyó que, algún día, cuando la acción de los medicamentos contra el cáncer “se entienda en términos bioquímicos, el campo de la quimioterapia contra el cáncer debería avanzar mucho más allá del progreso ya realizado. "
Después de que el Instituto del Cáncer Dana-Farber le diera prisa, Druker reunió una nueva resolución. "Cuando me mudé aquí a Oregon, mi objetivo era identificar una compañía farmacéutica que tuviera un medicamento para la CML y llevarlo a la clínica", dijo.
Anteriormente había conocido a Nick Lydon, un bioquímico de la firma farmacéutica suiza Ciba-Geigy (que se fusionaría con Sandoz en 1996 para formar Novartis). Lydon había colaborado con Roberts, el ex jefe de laboratorio de Druker. “Llamé a mi amigo Nick en Ciba-Geigy y me dijo: 'Tenemos lo que estás buscando'”. Se llamaba STI571. Los químicos de la compañía lo sintetizaron y otros compuestos mientras buscaban un nuevo medicamento antiinflamatorio, pero descubrieron que también podría bloquear la actividad de las enzimas en un tubo de ensayo. Aún así, no habían decidido qué hacer con el complejo.
En agosto de 1993, Druker recibió su primer lote de STI571 líquido y otro compuesto candidato de Suiza. Usando la herramienta de medición de enzimas que había ayudado a desarrollar, confirmó que STI571 inhibía fuertemente la enzima BCR-ABL, que pertenece a una clase de enzimas conocidas como tirosina quinasas; el otro compuesto lo hizo solo débilmente. También vertió pequeñas cantidades de STI571 en una bandeja de recipientes del tamaño de un dedal que contenía líquido y glóbulos blancos vivos derivados de un paciente con LMC. Druker esperaba que el crecimiento de las células se ralentizara o se detuviera. Aún mejor, las células murieron. Además, una gran cantidad de STI571 administrada a células sanas en un plato no causó daño. "La contribución de Brian fue crítica", recordó Lydon, al convencer a la compañía de "moverse en esa dirección".
Pero, por supuesto, el camino hacia las esperanzas frustradas está pavimentado con medicamentos experimentales que se veían geniales en un tubo de ensayo pero fallaron en los seres humanos. Los escépticos señalaron que cientos de diferentes tipos de enzimas de tirosina quinasa están trabajando en el cuerpo y, agregaron, ¿un medicamento que bloqueó a uno tampoco bloquearía a muchos otros y causaría estragos fisiológicos? "Hubo muchos detractores que argumentaron que sería imposible desarrollar inhibidores específicos de la proteína quinasa" para el tratamiento del cáncer, escribió Tony Hunter, un bioquímico del Instituto Salk en La Jolla, California, en el Journal of Clinical Investigation .
Las ideas científicas no echan raíces como las semillas de diente de león que flotan en tierra fértil. Necesitan abogados, personas que quieran ganar . Druker se desconectó, haciendo más experimentos, como inducir una forma de CML en ratones de laboratorio y someterlos a STI571. Casi eliminó la enfermedad de los animales. "Estaba trabajando entre 60 y 80 horas a la semana", recordó Druker, quien en su escaso tiempo libre compitió en carreras de bicicletas, un deporte que exige una alta tolerancia al dolor y una sensación de cuándo salir del grupo. "Mi vida en esos días era trabajar [en el laboratorio], entrenar, comer y dormir". Lo que lo estaba impulsando, dijo, eran pacientes con LMC que estaban muriendo.
En 1997, después de haber publicado numerosos estudios con compañeros de trabajo en Portland y Suiza, Druker creía que el compuesto estaba listo para ser probado en seres humanos. Novartis no estuvo de acuerdo. Por un lado, cuando los perros recibieron el medicamento en forma intravenosa, tendió a causar coágulos de sangre al final del catéter. Los químicos de Novartis pasaron meses reformulando el medicamento líquido como una píldora. Pero cuando los investigadores administraron grandes dosis a los perros, los animales mostraron signos de daño hepático. Algunos funcionarios de la compañía, recordó Druker, aconsejaron abandonar el proyecto por completo.
Pero el daño hepático canino no lo perturbó; La quimioterapia, después de todo, es destructiva. "Sabíamos cómo dar a las personas medicamentos contra el cáncer tóxicos", dijo.
Lo siguiente que hizo Druker puede no haber sido ilegal, pero ciertamente no fue kosher. Pasó por alto a Novartis y fue directamente a la Administración de Drogas y Alimentos para ver si había acumulado suficientes datos para comenzar un ensayo en humanos. “Llamé al toxicólogo de la FDA y le dije: 'Aquí está el problema'. Y él dijo: 'Dios mío, tienes un montón de datos, probablemente aceptaríamos esta solicitud' ”. Druker le contó a Novartis lo que había hecho. "Me metí en un poco de agua caliente porque había ido a sus espaldas".
Finalmente, en junio de 1998, con el permiso de la FDA para proceder, Druker administró STI571 a un ser humano, un hombre de Oregón de 68 años con LMC. "Fue casi anticlimático", recordó Druker, "en que habíamos estado listos en noviembre de 1996 y aquí fue más de un año y medio después".
Había reclutado a dos oncólogos eminentes para ayudar a ejecutar el ensayo clínico, Moshe Talpaz en el MD Anderson Cancer Center en Houston y Charles Sawyers en UCLA. Todos los pacientes con LMC inscritos en las tres ciudades habían recibido terapia con interferón y no habían mejorado o habían recaído. Ninguno era elegible para un trasplante de médula ósea.
Al aumentar gradualmente la dosis de STI571, los médicos observaron alrededor de seis meses que los recuentos astronómicos de glóbulos blancos de casi 100, 000 células por milímetro cúbico estaban cayendo a menos de 10, 000, dentro de lo normal. El análisis de los glóbulos blancos de uno de los primeros pacientes no encontró signos del cromosoma Filadelfia, lo que sugiere que la leucemia se había detenido en la fuente. Más impresionante, cualquier rastro del gen BCR-ABL que quedaba había dejado de copiarse. "Fue entonces cuando supimos que teníamos algo que nunca antes se había visto en la terapia contra el cáncer", dijo Druker.
Cuando se corrió la voz en Internet, otros pacientes con LMC querían ingresar. Druker presionó a Novartis para que produjera más del medicamento. Pero Novartis no estaba listo. El medicamento era difícil de fabricar, recordaría Daniel Vasella, entonces director ejecutivo de Novartis y ahora presidente de la junta, en su libro sobre el medicamento, Magic Cancer Bullet . "Tampoco era [la droga] una alta prioridad, dado el pequeño número de pacientes con LMC", agregó. Además, demostrar que era seguro y efectivo requeriría una inversión sustancial. "Se podría desarrollar un efecto secundario grave en uno de cada 1, 000 pacientes y ese sería el final del ensayo", escribió.
En septiembre de 1999, Druker recibió un correo electrónico de un paciente con LMC de 33 años en Montreal, Suzan McNamara. Había estado tomando interferón, que había suprimido su enfermedad durante casi un año, pero ahora estaba resurgiendo y quería unirse a un ensayo de STI571. "Estaba enferma hasta el punto de que apenas podía salir de mi casa", me recordó.
Druker la llamó por teléfono al día siguiente y le dijo que pasarían meses antes de que pudiera inscribirse en un estudio: Novartis no se había comprometido a producir más STI571. Pero, agregó, la compañía podría moverse más rápidamente si escuchara directamente de los pacientes.
McNamara y un amigo usaron un sitio de Internet para crear una petición solicitando que el medicamento esté más ampliamente disponible; miles de pacientes con LMC lo respaldaron. Se lo envió a Vasella con una carta que decía: "Hemos visto con creciente preocupación nuestra creencia ... de que el suministro del medicamento no ha sido suficiente para expandir los ensayos tan rápido como lo justifica la evidencia hasta la fecha".
"La carta no podía ser ignorada", dijo Vasella. La compañía aumentó la producción de STI571.
El honor de anunciar los primeros resultados clínicos recayó en Druker. En Nueva Orleans, el 3 de diciembre de 1999, le dijo a un auditorio lleno de hematólogos que los 31 pacientes en el estudio respondieron favorablemente a STI571, con el recuento de glóbulos blancos de 30 cayendo a la normalidad en un mes. Los efectos secundarios de la píldora (malestar estomacal, calambres musculares) fueron lo que los oncólogos llaman "leve a moderada". Druker dice que no recuerda la ovación de pie.
Los hallazgos fueron "el sueño de un oncólogo molecular hecho realidad", escribió Harold Varmus, quien ahora dirige el Instituto Nacional del Cáncer y fue galardonado con el Premio Nobel de investigación que sentó algunas de las bases para el éxito de STI571. El medicamento, recuerda en su libro de 2009, The Art and Politics of Science, fue "la mejor evidencia hasta la fecha de que los aspectos más fundamentales de la investigación del cáncer tuvieron beneficios dramáticos para los pacientes con cáncer".
CNN, el New York Times, "Good Morning America" y Associated Press cubrieron la revolucionaria píldora contra el cáncer.
Ola del futuro
Después de que LaDonna Lopossa y sus hijos se despidieron en febrero de 2000, ella se fue unos días más y asistió a una cita en OHSU. El oncólogo de LaDonna y George habían logrado llevarla a la segunda fase del ensayo STI571, que inscribiría a unos 500 pacientes nuevos en una docena de centros médicos en todo el mundo. Ella entró a la clínica en el brazo de George. "¿En qué nos hemos metido?", Dijo una de las enfermeras, lo que significa que la muerte de LaDonna, que parecía inminente, contaría como una marca negra contra la droga. Su recuento de glóbulos blancos superó los 200, 000, más de 20 veces lo normal. "No había dos formas de hacerlo", dijo Druker. "La miraste y ella estaba en problemas".
La examinaron y le dieron una pastilla STI571. Ella lo vomitó.
A la mañana siguiente, George y LaDonna se despertaron en el apartamento de su hermana en Portland y George hizo de LaDonna un batido de plátano. Más tarde ese día, la píldora STI571 se quedó abajo. Y el siguiente, y así sucesivamente.
"En tres semanas su bazo volvió a ser prácticamente normal", dijo Druker. “Ella se sentía genial. La cuenta blanca había bajado. Un efecto parecido a Lázaro. Fue realmente milagroso ".
Fue en mayo de ese mismo año que LaDonna y George visitaron el cementerio en Winlock para colocar flores en la tumba de su madre, que está al lado de la parcela que LaDonna se había comprado. "Se supone que debo estar en esa tumba", le dijo a George.
"Bueno", dijo, "ya que no lo eres, ¿por qué no tomamos una foto?"
A fines del invierno de 2001, Druker y sus colaboradores habían agrupado gran parte de sus datos STI571: en aproximadamente el 95 por ciento de los pacientes, los niveles de glóbulos blancos habían vuelto a la normalidad y en el 60 por ciento no se detectó el cromosoma Filadelfia. La compañía presentó los resultados con su solicitud de nuevos medicamentos a la FDA, que aprobó en dos meses y medio, hasta el día de hoy, la revisión de medicamentos más rápida en la historia de la agencia.
Hace diez años, este mes, el gobierno de EE. UU. Anunció que el medicamento, que Novartis llamó Gleevec en el mercado norteamericano (Glivec en Europa), estaría disponible para los pacientes con LMC. Fue un momento decisivo. El siglo anterior de tratamientos contra el cáncer, intermitentemente exitoso, basado en pruebas de ensayo y error, casi siempre agonizantes, sería conocido por los expertos como "antes de Gleevec". A partir de entonces fue "después de Gleevec", la era de la terapia dirigida. En una conferencia de prensa en Washington, DC, el 10 de mayo, el Secretario de Salud y Servicios Humanos, Tommy Thompson, calificó el medicamento como un "avance" y "la ola del futuro". El entonces director del Instituto Nacional del Cáncer, Richard Klausner, lo describió como "una imagen del futuro del tratamiento del cáncer".
Hoy, Suzan McNamara estaría de acuerdo en que el futuro es bueno. Cuando viajó a Portland por primera vez en 2000 para participar en el estudio de Gleevec, recordó: “Fui allí con la mitad de mi cabello y anoréxica, y ni siquiera podía subir un tramo de escaleras. Y regresé en un mes y medio, 20 libras más pesado y lleno de vida ”. Sus siguientes pasos fueron asistir a la Universidad McGill, estudiar terapias contra la leucemia y obtener un doctorado en medicina experimental. Ahora de 44 años, vive en Montreal y trabaja en Ottawa para Health Canada, una agencia federal. Todavía en Gleevec, corre varias millas varias veces a la semana. "Yo iría más si no fuera tan vago", dijo. En enero de 2010 se casó con su novio de toda la vida, Derek Tahamont, en Hawai. "Él estuvo a mi lado durante toda la enfermedad y todo", dijo. “Decidimos subirnos a un avión y casarnos en una playa, solo nosotros dos. Fue perfecto."
Gleevec ha alentado a las personas a pensar que el cáncer no siempre es un invasor mortal que debe ser aniquilado, sino una enfermedad crónica que se puede controlar, como la diabetes. En estudios de seguimiento dirigidos por Druker, alrededor del 90 por ciento de los pacientes con LMC recién diagnosticados que comenzaron a tomar Gleevec habían sobrevivido cinco años. "Les digo a los pacientes lo optimista que soy sobre su futuro", dijo Druker. “Estamos proyectando para Gleevec que la supervivencia promedio será de 30 años. Alguien diagnosticado a los 60 años puede vivir hasta los 90 y morir de otra cosa ".
Cuando LaDonna Lopossa tenía 60 años, recordó, Druker dijo que la mantendría con vida hasta que tuviera 70. Luego alcanzó ese hito. "Quise decir cuando cumplí 70", bromeó con ella entonces.
LaDonna, ahora de 71 años, y George, de 68, viven en Battle Ground, Washington, una ciudad rural a 24 millas al norte de OHSU, donde LaDonna permanece bajo el cuidado de Druker. Los Lopossas viven en un bungalow en un complejo de viviendas para personas de la tercera edad subsidiado por el estado al otro lado de la calle de una familia que mantiene a las gallinas en el patio y le permite a George cultivar hierbas. Un anuncio de revista enmarcado para Gleevec con LaDonna cuelga en la pared de una sala de estar. Dos retratos de Cristo adornan una pared del comedor. George, quien se apresura a decir que no es religioso: "nadie sabe cómo era Jesús", bromeó sobre la iconografía de LaDonna, tiene su propia guarida, donde ve "Family Guy".
LaDonna se ofrece voluntaria en el Banco de Alimentos de la Comunidad del Condado del Norte en la calle, en la iglesia mormona a la que pertenece y, por teléfono, aconseja a las personas recién diagnosticadas con LMC para la Sociedad de Leucemia y Linfoma. Uno de sus mayores desafíos en estos días, dijo, es convencer a los pacientes para que sigan tomando Gleevec; no han soportado los síntomas de la CML fulminante y algunos encuentran molestos los efectos secundarios del medicamento.
Gleevec mantuvo a raya la CML de LaDonna durante siete años, momento en el que su enfermedad se volvió resistente a la droga. Afortunadamente, los científicos médicos y las compañías farmacéuticas habían desarrollado dos nuevos medicamentos para la CML, cada uno de los cuales desactivaba la enzima BCR-ABL de una manera diferente y compensaba un tipo de resistencia a Gleevec. Sprycel no ayudó a LaDonna, pero Tasigna lo hizo, durante unos dos años. Ahora está tomando su cuarto medicamento dirigido contra la LMC, bosutinib, que aún es experimental. "Su leucemia es la mejor controlada que haya tenido desde que la cuidé en los últimos 11 años", dijo Druker.
Oncología personalizada
Sentado en la pequeña mesa de conferencias redonda en su pequeña oficina de la esquina en lo alto de Marquam Hill, Druker dijo que todavía estaba estudiando CML, con la esperanza de entender cómo eliminar cada última célula madre mutante, y también estaba tratando de aplicar "el paradigma Gleevec" a otras leucemias Un jersey amarillo brillante de ciclismo usado y autografiado por el campeón del Tour de Francia y el sobreviviente de cáncer Lance Armstrong colgaba enmarcado en la pared. Era un día despejado y la gran bola de helado de vainilla del Monte St. Helens se veía por la ventana hacia el norte y el triángulo blanco del libro de cuentos del Monte Hood se podía ver a través de la ventana hacia el este. El tipo que no tenía las cosas adecuadas para ser profesor asistente de Harvard es hoy el director del Instituto de Cáncer Knight de OHSU, llamado así por Phil Knight, el fundador de Nike y un nativo de Portland, y su esposa, Penny, quien en 2008 prometió $ 100 millones para la instalación. "Brian Druker es un genio y un visionario", dijo Phil Knight en ese momento.
Los honores se han acumulado, incluido el premio más importante de EE. UU., El Premio de Investigación Clínica Médica Lasker-DeBakey, que Druker compartió en 2009 con Lydon y Sawyers. De sus muchas apariciones en los medios de comunicación, ninguna cambiaría su vida más que una historia sobre él en People, "The Miracle Worker", publicada en febrero de 2001. La revista había enviado a una periodista llamada Alexandra Hardy para entrevistar al médico asesino de dragones en El hospital en las nubes. Los dos se casaron en 2002 y son padres de Holden, Julia y Claire. Druker dijo: “Ahora tengo la capacidad de enfocarme en la familia como una prioridad. No podría haberlo hecho hace 10 o 15 años ".
Para algunos observadores, la fábula de Gleevec pronto perdió su brillo. "El 'medicamento maravilloso' para la leucemia sufre un revés", informó el Wall Street Journal en 2002 una vez que algunos pacientes se volvieron resistentes al medicamento o no pudieron tolerarlo. Además, parecía que los investigadores tardaron en producir otros medicamentos destinados a domar otros tipos de cáncer, lo que pone en duda la promesa de la estrategia. Un reportero de Time escribió en 2006 que Gleevec era una "droga de Cenicienta", una zapatilla de vidrio que se ajustaba a un candidato singular. Sawyers dijo que se cansó de que los investigadores dijeran que Gleevec era un disparo único y afortunado.
El costo del medicamento ha sido controvertido desde el día 1. El suministro de un año en los Estados Unidos ahora cuesta alrededor de $ 50, 000, o alrededor de $ 140 por píldora diaria. Eso es el doble del costo original, que Vasella había defendido como "alto" pero también "justo", porque el medicamento brinda a los pacientes una buena calidad de vida y los ingresos de la compañía respaldan la investigación de otros medicamentos. (Cuando se le preguntó sobre los motivos del aumento de precios, una portavoz de Novartis se negó a comentar). En cualquier caso, un medicamento que Novartis se negó a desarrollar porque el mercado era demasiado pequeño ahora es un éxito de taquilla. En 2010, Gleevec generó $ 4.3 mil millones en ventas a nivel mundial, el segundo medicamento de mayor recaudación de la compañía. Para estar seguros, Novartis ha proporcionado medicamentos gratuitos o con descuento a pacientes de bajos ingresos. En 2010, la compañía ayudó a unos 5, 000 pacientes de los Estados Unidos al donarles $ 130 millones en Gleevec y Tasigna, también un medicamento Novartis.
Pero los pacientes, los médicos y otros se han quejado durante mucho tiempo sobre el precio de Gleevec. En su libro de 2004, La verdad sobre las compañías farmacéuticas, Marcia Angell, ex editora del New England Journal of Medicine, sugirió que Novartis estaba "desgarrando" pacientes en Gleevec. Recientemente, los médicos informaron que los pacientes dejaron de tomar Gleevec porque no podían pagarlo, a pesar del programa de asistencia de la compañía.
Druker, quien dijo que su laboratorio recibió fondos de investigación de Novartis pero que ni él ni OHSU obtuvieron regalías de Gleevec, lamenta el costo. "Debería ser un precio asequible, que estaría en el rango de $ 6, 000 a $ 8, 000 al año", me dijo. "La compañía aún tendría muchas ganancias". Continuó: "Muchos medicamentos contra el cáncer ahora tienen un precio muy bueno fuera del alcance de la asequibilidad". Como industria del cuidado de la salud, vamos a tener que abordar y lidiar con eso ”.
Habrá mucho que tratar: parece que Gleevec no fue simplemente un golpe de suerte. El solo hecho de que los científicos diseñaron rápidamente nuevos medicamentos para hacer frente a la resistencia de Gleevec muestra que cada vez saben más lo que están haciendo, dijo Sawyers, ahora en el Centro de Cáncer Memorial Sloan-Kettering. Lideró un grupo que fue el primero en explicar la resistencia y estuvo involucrado en el desarrollo de Sprycel. "¿Por qué soy tan optimista?", Dijo. "Conocemos al enemigo y sabemos cómo vencerlo".
De hecho, varias terapias contra el cáncer dirigidas a enzimas obtuvieron la aprobación de la FDA en la estela de Gleevec, incluidos medicamentos contra formas particulares de cáncer de pulmón y cáncer de páncreas. Y los investigadores dicen que están alentados por los tratamientos en ensayos clínicos. Algunos pacientes con melanoma cuya enfermedad es causada por una mutación genética conocida parecen beneficiarse enormemente de un medicamento experimental llamado PLX4032. Sawyers está estudiando una forma de cáncer de próstata estimulado por un receptor hormonal mutante, y dijo que las pruebas clínicas de un medicamento (llamado MDV3100) dirigido contra él son "emocionantes". Un análisis de la industria farmacéutica estima que las compañías farmacéuticas actualmente están desarrollando y probando casi 300 terapias dirigidas contra el cáncer molecular a la Gleevec.
Arul Chinnaiyan, un patólogo investigador especializado en cáncer en la Facultad de Medicina de la Universidad de Michigan, en Ann Arbor, es franco sobre la influencia de Gleevec. "Estamos tratando de franquiciar su éxito", dijo sobre sus intentos de aplicar el enfoque de terapia dirigida a los tumores sólidos, que son más complejos que la CML. Cada tipo de tumor sólido puede ser impulsado por múltiples enzimas y receptores errantes, estructuras de proteínas que transmiten mensajes químicos, y la variedad de mutaciones puede variar de persona a persona. Chinnaiyan mismo ha descubierto dos fusiones de genes mutantes diferentes análogas a BCR-ABL que parecen conducir muchos cánceres de próstata. "La idea es que si sabemos que estas son las lesiones moleculares, podremos igualar el medicamento o la combinación de medicamentos de manera apropiada", dijo Chinnaiyan.
Tuve una idea de lo que él llama "oncología personalizada" un día en un pub de cerveza en Ann Arbor. Al otro lado de la mesa de madera con cicatrices, comiendo una hamburguesa con queso y tocino y bebiendo cerveza, estaba Jerry Mayfield, de 62 años, un ex policía del estado de Louisiana. Diagnosticado con CML en 1999, su hematólogo le dijo a Mayfield en ese momento que tenía dos o tres años de vida. Mayfield preguntó si había drogas experimentales para considerar. El doctor dijo que no. Mayfield revisó Internet, se enteró de STI571 y, habiéndose enseñado a sí mismo la programación de computadoras mientras manejaba el escritorio nocturno en la sede de la policía en Monroe, creó un sitio web, newcmldrug.com, para informar a otros pacientes. Si hubiera escuchado al médico de su ciudad natal, Mayfield dijo, "sin duda no estaría aquí hoy".
Todavía dirige su sitio web y actualmente vive en Bloomington, Illinois. Estaba en Ann Arbor para ver a Talpaz, que había colaborado en los ensayos clínicos iniciales de Gleevec en Houston pero se había mudado a la Universidad de Michigan. Se ha ocupado de Mayfield durante más de una década, administrando terapias dirigidas en sucesión a medida que Mayfield se volvió resistente o ya no podía tolerarlas: Gleevec, Sprycel, Tasigna, bosutinib y ahora ponatinib, otra carrera experimental de drogas CML bloqueadoras de quinasas a través de la clínica. juicios.
Mayfield es "un chico aficionado a la terapia de LMC", me dijo Talpaz. "Lo está haciendo extremadamente bien".
Sobre la música estruendosa del pub, Mayfield dijo de su gen BCR-ABL: "Tuve la mutación G250E, tengo la mutación G250E, por eso me hice resistente a Gleevec".
Su comentario sonaba como algo sacado de una máquina del tiempo programada para años o décadas a partir de ahora, cuando las personas hablarán despreocupadamente sobre sus mutaciones genéticas mortales y las drogas que las obstaculizan. Es una imagen que Druker a menudo evoca. "En un futuro no muy lejano", escribió al aceptar el Premio Lasker-DeBakey, "los médicos podrán analizar minuciosamente los tumores moleculares de los individuos para detectar defectos moleculares y unir a cada persona con terapias específicas y efectivas que produzcan una respuesta duradera con mínima toxicidad ".
Mayfield nunca ha sido tratado por Druker pero lo ha consultado. "Estaba sentado en la oficina de mi oncólogo local un día hace diez años, y mi teléfono sonó", dijo Mayfield. “Fue el Dr. Druker. Le envié un correo electrónico. Estaba aturdido Le dije a mi oncólogo: "Es grosero responder a esta llamada, pero este es mi héroe". Es un hombre tan amable, gentil y dedicado, ni un poco arrogante. Él ha salvado tantas vidas. Todos en el país deberían saber su nombre. Es el tipo de ídolo que deberíamos tener, en lugar de las estrellas del deporte ".
El sitio web de Mayfield tiene un "álbum de agradecimiento" dedicado a Druker, lleno de homenajes de pacientes con LMC. Instantánea tras instantánea muestra a la gente sonriendo a la luz del sol (senderismo, plantando árboles, bebiendo champán), personas que se sintieron conmovidas al decir que se lo debían, bueno, todo . Presentaron docenas de poemas y limericks, como este de una paciente llamada Jane Graham:
Había una vez un médico llamado Brian
En cuya investigación todos confiamos
Él sabía que estábamos enfermos
Entonces nos hizo una píldora,
Y ahora no estamos planeando morir.
Contrario a las expectativas
Druker se reunió con LaDonna Lopossa en la sala de examen donde ve pacientes de estudio todos los jueves. George, quien dice que LaDonna tiene una "cualidad de Molly Brown insumergible", la había echado del campo de batalla para su chequeo. Se sentó en una silla mientras Druker, con un traje azul oscuro holgado, se apoyaba contra el borde de una mesa de examen. "No estaría aquí sin ti", dijo LaDonna (posiblemente para mi beneficio).
"Bueno, estás aquí", dijo Druker. "Lo estás haciendo bien."
"Estoy bailando bien en las calles".
"Excelente. ¿Algún problema?
"No. Solo tengo una erupción.
"¿Cuándo comenzó eso?"
"Hace unas diez semanas".
Me preguntó por el sarpullido, y luego saldría de la habitación para que él pudiera examinarla.
“¿Sigues trabajando en el banco de alimentos?”, Preguntó.
"Estoy haciendo un día a la semana".
"¿Como va eso?"
"Estupendo."
"¿Cómo está tu energía?"
“Mi energía es baja. Pero mi cerebro está activo ".
"Lo estás haciendo espectacularmente, en cuanto a leucemia".
"Lo sé. Puedo sentirlo."
"¿Qué más? ¿Preguntas para mí?
"Me voy de viaje mañana".
"¿A?"
"San Diego y Knott's Berry Farm con todos mis nietos". Actualizó su progreso y Druker recitó sus edades, como para comprobar que tenía los datos correctos. Cuando se dirige a científicos en conferencias profesionales, a menudo muestra fotografías de LaDonna y sus nietos. Contrario a todas las expectativas, dice, ella está viendo cómo crecen sus bisnietos.
"Tengo una vida tan maravillosa", dijo LaDonna, llorando. “Y no lo quería. Les dije a mis médicos: 'No me hagas más'. "
Se secó los ojos con un pañuelo y mencionó su primera visita a la clínica, en 2000, cuando apenas había cruzado la puerta. "Eso fue hace mucho tiempo", dijo a nadie en particular.
Luego, a Druker, ella dijo: "Pero se ha ido rápido, ¿no?"
"¿No es así?", Dijo.
Terence Monmaney escribió por primera vez para Smithsonian en 1985. Es el editor ejecutivo. Robbie McClaran, con sede en Portland, fotografió a su ciudad natal adoptada para el número de noviembre de 2010.








 LaDonna Lapossa adopta una pose en la cima de su parcela en el cementerio en 2000. (Cortesía de Ladonna Lapossa)
LaDonna Lapossa adopta una pose en la cima de su parcela en el cementerio en 2000. (Cortesía de Ladonna Lapossa)  "Estamos viendo el comienzo de comparar a los pacientes con el medicamento correcto y estamos viendo mejoras rápidas", dice el Dr. Brian Druker. (Robbie McClaran)
"Estamos viendo el comienzo de comparar a los pacientes con el medicamento correcto y estamos viendo mejoras rápidas", dice el Dr. Brian Druker. (Robbie McClaran)  Al ser diagnosticado con leucemia en 1999, a Jerry Mayfield, en su casa en Bloomington, Illinois, le dijeron que tenía dos o tres años de vida. " Esperaba ver el milenio", dice el ex policía estatal, que creó un sitio web sobre una nueva terapia que comenzó a tomar. (Tim Klein)
Al ser diagnosticado con leucemia en 1999, a Jerry Mayfield, en su casa en Bloomington, Illinois, le dijeron que tenía dos o tres años de vida. " Esperaba ver el milenio", dice el ex policía estatal, que creó un sitio web sobre una nueva terapia que comenzó a tomar. (Tim Klein)  Gravemente enferma de leucemia, Suzan McNamara comenzó a tomar el medicamento Gleevec en 2000. Diez años después, se casó en Hawai. (Cortesía de Suzan McNamara)
Gravemente enferma de leucemia, Suzan McNamara comenzó a tomar el medicamento Gleevec en 2000. Diez años después, se casó en Hawai. (Cortesía de Suzan McNamara)  "Este es un momento muy emocionante para estar en la investigación del cáncer", dice Arul Chinnaiyan (aquí, en su laboratorio de la Universidad de Michigan), inspirado por el éxito de Gleevec. "Soy una tecnología muy optimista hasta el punto en que podemos encontrar los orígenes genéticos de los diferentes tipos de cáncer". (Fabrizio Costantini / Aurora Select)
"Este es un momento muy emocionante para estar en la investigación del cáncer", dice Arul Chinnaiyan (aquí, en su laboratorio de la Universidad de Michigan), inspirado por el éxito de Gleevec. "Soy una tecnología muy optimista hasta el punto en que podemos encontrar los orígenes genéticos de los diferentes tipos de cáncer". (Fabrizio Costantini / Aurora Select)  "Cuando casi mueres, obtienes una perspectiva diferente de la vida", dice Lopossa, en su casa con su esposo, George. "Tienes más aprecio por lo que tenemos". (Robbie McClaran)
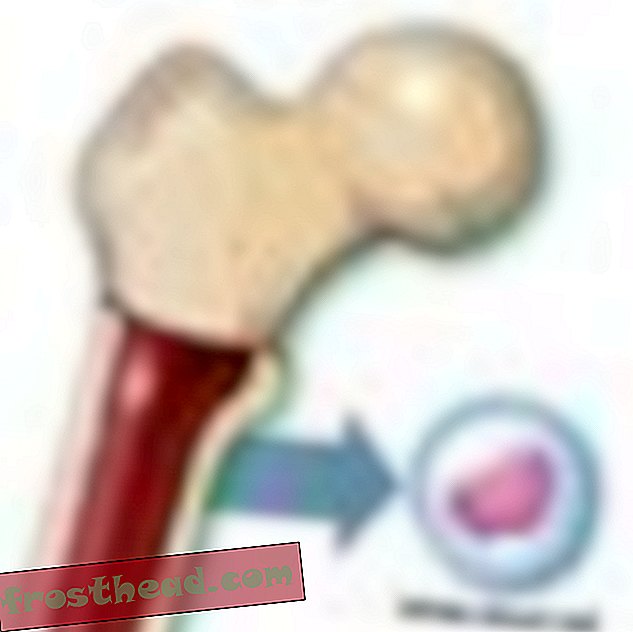
"Cuando casi mueres, obtienes una perspectiva diferente de la vida", dice Lopossa, en su casa con su esposo, George. "Tienes más aprecio por lo que tenemos". (Robbie McClaran) 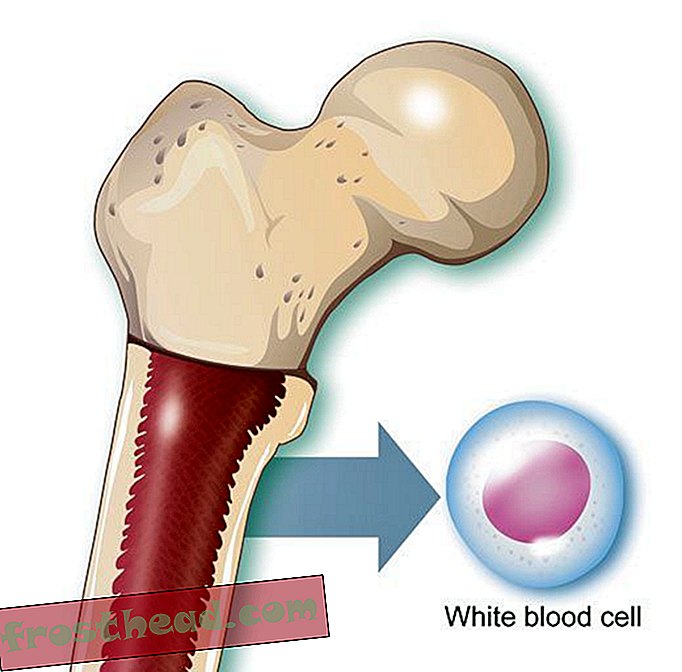 ¿Qué causa un cáncer de sangre mortal?> Producción de células > En la médula ósea, algunas células madre producen corpúsculos rojos que transportan oxígeno, mientras que otras crean glóbulos blancos, o leucocitos, que en su mayoría curan lesiones y combaten infecciones. El pus de una herida infectada está teñido de blanco en gran parte por los leucocitos. (Ilustración para Smithsonian )
¿Qué causa un cáncer de sangre mortal?> Producción de células > En la médula ósea, algunas células madre producen corpúsculos rojos que transportan oxígeno, mientras que otras crean glóbulos blancos, o leucocitos, que en su mayoría curan lesiones y combaten infecciones. El pus de una herida infectada está teñido de blanco en gran parte por los leucocitos. (Ilustración para Smithsonian ) 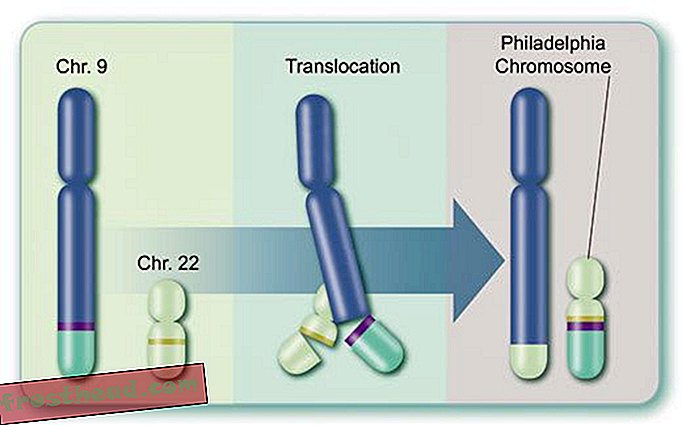 Cromosomas Accidentalmente se cruzan caminos br> CML surge cuando una célula madre se equivoca durante la división. En lugar de que los 23 pares de cromosomas se dupliquen con precisión, los bits de los cromosomas No. 9 y No. 22 cambian de lugar, creando un "cromosoma Filadelfia" aberrante con un gen mutante. (Ilustración para Smithsonian )
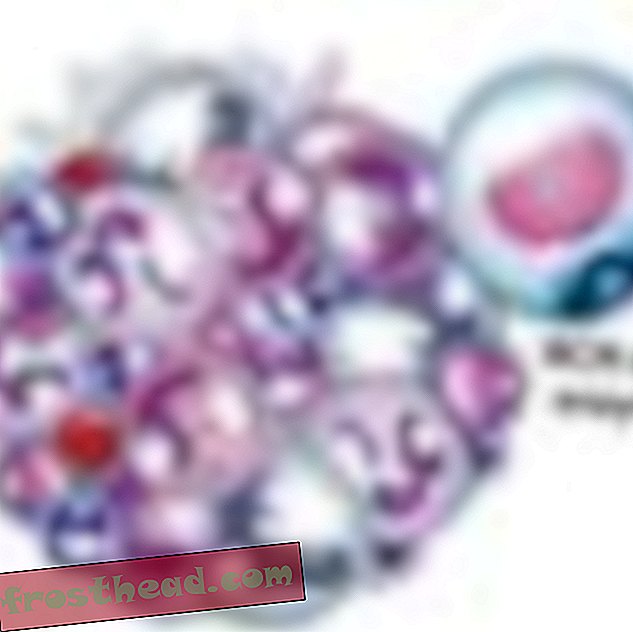
Cromosomas Accidentalmente se cruzan caminos br> CML surge cuando una célula madre se equivoca durante la división. En lugar de que los 23 pares de cromosomas se dupliquen con precisión, los bits de los cromosomas No. 9 y No. 22 cambian de lugar, creando un "cromosoma Filadelfia" aberrante con un gen mutante. (Ilustración para Smithsonian ) 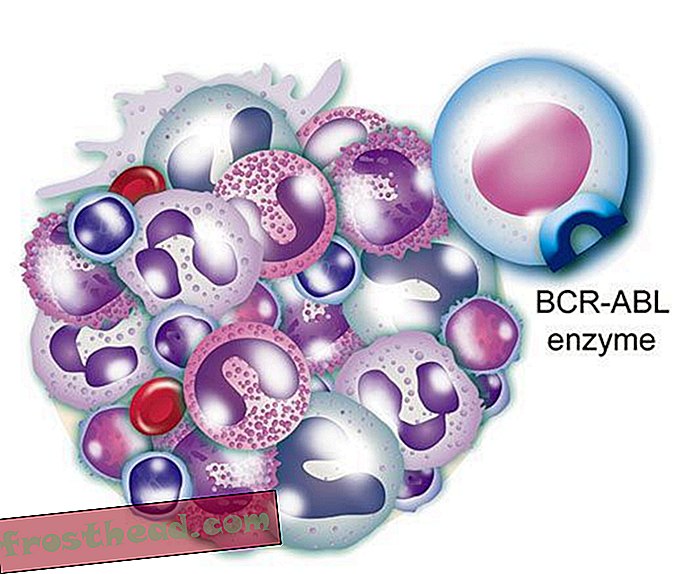 Un fármaco que alcanza el objetivo br> El gen mutante fabrica una enzima renegada del mismo nombre, BCR-ABL. Impulsa la división descontrolada de glóbulos blancos o leucemia. (Ilustración para Smithsonian )
Un fármaco que alcanza el objetivo br> El gen mutante fabrica una enzima renegada del mismo nombre, BCR-ABL. Impulsa la división descontrolada de glóbulos blancos o leucemia. (Ilustración para Smithsonian ) 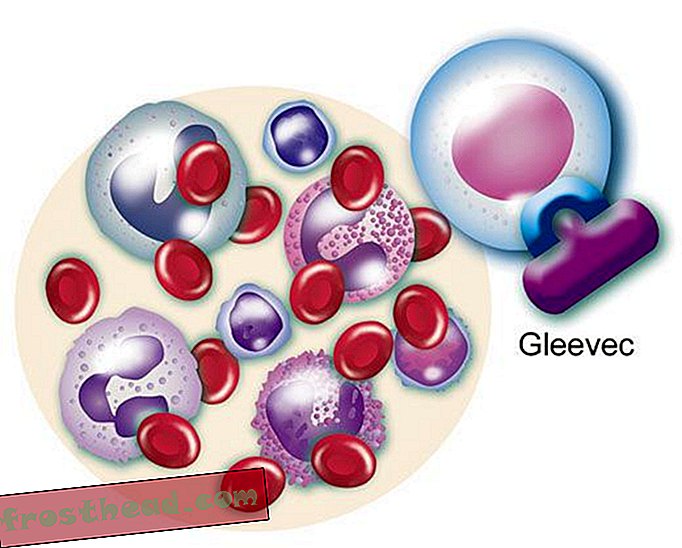 Un fármaco que alcanza el objetivo br> El fármaco CML Gleevec bloquea esa forma de bloqueo y clave de enzimas dentro de la célula, restaurando el crecimiento normal de los glóbulos blancos. (Ilustración para Smithsonian )
Un fármaco que alcanza el objetivo br> El fármaco CML Gleevec bloquea esa forma de bloqueo y clave de enzimas dentro de la célula, restaurando el crecimiento normal de los glóbulos blancos. (Ilustración para Smithsonian )